El agujero macular es una solución de continuidad del espesor en forma parcial o total del tejido retiniano en el área foveal. Puede ser el resultado de un traumatismo, edema macular crónico o idiopático.
Hasta hace poco tiempo la clasificación de los estadios y la patogénesis se basaba principalmente en el aspecto clínico y en la fluoroangiografía (FAG).
Actualmente la Tomografía Óptica de Coherencia (OCT) desempeña un papel muy importante en la comprensión de la patogénesis del agujero macular, permite su monitoreo y el establecimiento del pronóstico del resultado quirúrgico. En los pacientes a quienes se practicará cirugía en presencia de agujero macular unilateral, el OCT provee información útil que puede ayudar a predecir el riesgo de afectación del otro ojo.
Imagen: Agujero macular con dehiscencia de espesor total y desprendimiento de vítreo posterior (DVP)
Patogénesis del agujero macular
Los estudios iniciales de OCT mostraban al traumatismo ocular como la principal causa de agujero macular. En los idiopáticos tempranos, se creía que los cambios quísticos en la macula y la formación del quiste macular eran los causantes del agujero.
En los inicios del siglo XX, Schepens introdujo la idea de la participación de la tracción vítrea en su patogénesis. Existen diferentes teorías sobre el papel de la tracción vítrea en la patogénesis del agujero macular.
Algunas de la observaciones iniciales fueron que el desprendimiento de vítreo posterior (DVP) ejerce una tracción anteroposterior y esto conlleva la formación de un agujero macular.
Gass dio a conocer su teoría de tracción vitreomacular tangencial en 1988 y sugirió que el agujero es originado por un desplazamiento centrifugo de los fotorreceptores y por la pérdida de la depresión foveal con la formación de un punto amarillo de 100 a 200 micras en el estadio 1a que es el primer paso en la formación del agujero macular el cual es seguido por la aparición de un anillo amarillo de 200 a 300 micras en el estadio 1b.
El defecto excéntrico en la totalidad del grosor, menor de 400 micras, cursa con la separación vítreo-foveal (DVP total) en el estadio 4.
El modo exacto de acción de la tracción aún es tema de controversia, entre otras causas porque la hialoides posterior es habitualmente invisible.
Los estudios de OCT han demostrado desprendimiento de vítreo perifoveal, como en la separación localizada del vítreo posterior con adhesión persistente del mismo a la fóvea en los estadios 1 y 2.
El OCT realizado en estadios iniciales del agujero macular demuestra que la tracción en estadios iniciales es ligeramente oblicua más que tangencial y el desprendimiento vítreo perifoveal es el primer paso en su formación.
También ha demostrado que en el estadio 1 se presenta más comúnmente un pseudoquiste, y muy rara vez un desprendimiento foveal como fue preconizado por Gass.
El pseudoquiste es seguido de dehiscencia foveal, que se extiende dentro de las capas internas y externas de la retina; y después su techo se abre hacia arriba para producir un agujero macular de grosor total.
De manera similar a las observaciones histopatológicas, el OCT demuestra la ausencia de todo el tejido retiniano en el sitio del agujero, con sus márgenes redondeados; también revela la asociación del agujero macular con cambios quísticos y edema macular quístico, MER, desprendimiento parcial o total del vítreo, atrofia del EPR e hipertrofia o tejido residual en la base del agujero macular lamelar.
Imagen: Agujero macular con dehiscencia de espesor total y tracción
OCT en varios estadios de agujeros maculares
Estadio 1:
•Estadio 1a: Desprendimiento foveal con punto amarillo. El OCT muestra un espacio quístico ocupando la parte interna del tejido foveal.
•Estadio 1b: Desprendimiento foveolar con halo amarillo. El OCT muestra un agujero inminente con extensión del espacio quístico posterior interrumpiendo las capas externas de la retina.
Estadio 2: Formación de agujeros excéntricos diminutos. El OCT muestra la apertura excéntrica del techo del agujero con la presencia de un opérculo.
Estadio 3: Agujero macular de espesor total con o si opérculo. El OCT muestra un agujero macular central de espesor total con desprendimiento de vítreo posterior.
Estadio 4: Agujero macular de espesor total con desprendimiento de vítreo posterior. El OCT muestra un agujero macular central de espesor total con presencia de líquido subretiniano y desprendimiento de vítreo posterior completo.
Papel del OCT en ojos contralaterales
El estudio Eye Disorder Case Control Study (EDCCS) mostró que existe un 7.1% de posibilidad de que surgiera un agujero macular en el ojo no afectado a los 6 o más años de seguimiento. El OCT es muy sensible para detectar tempranamente cambios vitreorretinianos y predecir el riesgo del desarrollo de agujero macular en ojos contralaterales.
Chan y colaboradores describieron el estadio 0 del agujero macular en ojos contralaterales de pacientes que se operarían de agujero macular idiopático. Observaron un patrón distinto en el OCT en algunos ojos antes de la formación del estadio 1.
Parul y colaboradores dan esta clasificación:
•Leve: El OCT revela una banda prerretiniana mínimamente delgada, bien definida y sin fijación/inserción al área foveal.
•Moderada: El OCT muestra una banda delgada minimamente reflectiva, claramente insertada a la fóvea y hacia algún otro sitio.
•Severa: El OCT muestra una banda minimamente reflectiva localizada a ambos lados de la fóvea claramente insertada en la región perifoveal.
Parul y colaboradores observaron que existe en ojos con agujero macula estadio 0 un 42% de riesgo de desarrollo de un agujero macular de espesor total.
Duker y colaboradores observaron en los ojos contralaterales de 56 pacientes que el 21 % de los ojos tenían interfase vitreofoveal anormal con etapa 3-4, el 7% tenían agujero macular en etapa 1, el 4% lo tenían en etapa 3 y el 7% presentaban agujero macular lamelar.
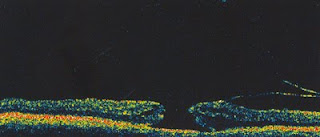
Imagen: Agujero macular en formación con disrupción de retina
Pronóstico de resultados visuales
Diámetro del agujero: Según Michael y colaboradores, se puede, mediante OCT, determinar en el preoperatorio el cierre postoperatorio de un agujero macular idiopático de acuerdo con el diámetro del agujero. Los agujeros menores a 400 micras presentan un 92% de cierre. Con diámetro mayor de 400 micras, el porcentaje de cierre se redujo a 56%. La mejoría de la AV fue también mayor en agujeros con diámetros menores a 400 micras. Estos autores notaron también que la reapertura tardía del agujero macular a los 6 meses o más de la cirugía se observó solo en agujeros mayores a 400 micras.
Factor de la forma del agujero: Ullrich introdujo el concepto de factor de la forma del agujero macular (HFF en inglés) para evaluar el papel del OCT en la predicción funcional y anatómica después de cirugía de agujero macular. El HFF se calcula midiendo los diámetros del agujero a nivel del EPR (diámetro base) y en el de menor diámetro (diámetro mínimo). Las dimensiones verticales oblicuas se miden a nivel del diámetro del agujero menor. Los autores notaron un 100% de cierre del agujero en HFF > 0.9 y 67% en HFF menor a 0.5 después de cirugía. El resultado visual fue significativamente menor en ojos con alto HFF.
Índice del agujero macular (MHI en inglés): El MHI se calcula con el OCT en “line scan” en el área macular. Es el índice de la altura del agujero macular al diámetro base del agujero, así refiriéndose como dimensiones horizontales y verticales del agujero visualizándolas en corte transversal. Los valores superiores indican un diámetro horizontal pequeño del agujero y vertical más grande. Los autores sugieren que el MHI es más fácil de calcular que el HFF. El MHI tiene una buena correlación con la mejoría postoperatoria. Un MHI superior a 0.5 significa un mejor AV corregida que un MHI inferior a 0.5.
Monitoreo postoperatorio del cierre del agujero macular y su categorización
Algunos autores han clasificado el estado del agujero macular después de una cirugía en elevado/ abierto, plano abierto y plano cerrado. Kang y colaboradores lo han clasificado en:
•Cierre tipo 1: agujero cerrado sin defecto retiniano neurosensorial,
•Cierre tipo 2: agujero cerrado con defecto neurosensorial, El cierre tipo 1 tiene mejor agudeza visual y un agujero macular preoperatorio más pequeño que los ojos con cierre tipo 2.
Según Parul y colaboradores, el OCT ayuda en la confirmación del cierre anatómico del agujero. También proporciona información acerca de los cambios tomográficos y los cambios submaculares del EPR después de cirugía.

Imagen. Agujero macular en formación en formación con pseudoquiste foveal
Diferenciación entre el verdadero agujero macular, el agujero macular lamelar y el pseudoagujero
El OCT es una herramienta valiosa para diferenciar verdaderos agujeros maculares de grosor total de los agujeros maculares lamelares y de los pseudoagujeros.
Agujero macular lamelar
Puede resultar de una apertura macular parcial de un quiste. El OCT demuestra un agujero de espesor parcial con tejido neurosensorial residual en la base. El piso foveal es delgado e irregular con bordes foveales escindidos. El promedio del grosor macular central en estos ojos es usualmente menor cuando se compara al grosor macular de ojos normales y el grosor perifoveal está cerca de lo normal.
Pseudoagujero macular
Los pseudoagujeros maculares deben ser diferenciados de los verdaderos agujeros maculares. Los verdaderos agujeros maculares son el resultado de la dehiscencia de la membrana premacular gliótica. Al examen clínico, en los pseudoagujeros, la membrana epirretiniana con un defecto central puede, en muchos casos, simular un agujero macular. Sus márgenes pueden ser bien definidos pero usualmente de forma irregular. Las membranas epirretinianas se observan como bandas lineales con moderada a alta reflectividad, anteriores a la retina con fijación focal o difusa. El OCT muestra claramente un escalón foveal en un agujero con bordes foveales engrosados y en agujeros foveales de diámetro pequeño. El grosor foveal central en estos ojos generalmente es normal o está aumentado en comparación con el grosor macular en ojos normales. El grosor medio perifoveal es también mayor al normal.
Bibliografía
1.Hee MR et al; Optical coherence tomography of macular Holes. Opthalmology 1995; 748-56.
2.Chan A., et al, Stage 0 macular holes: Observation by optical coherence tomography. Ophthalmology 2004; 111:2027-32.
3.Michael S., et al, Anatomical outcomes of surgery idiopathic macular hole as determined by optical coherence tomography. Arch ophthamol. 2002; 120:29-35.
4.Ulfrich S., et al, Macular hole size as a prognostic factor in macular hole surgery. Br J Ophthalmol 2002; 86:390-93.
5.Kusuhara S., et al, Predication of postoperative visual outcome based on hole configuration by optical chorence tomography in eyes with idiopathic macular holes. Am J. Ophthalmol 2004; 138:709-16.
6.Kang SW., et al Types of macular hole closure and their clinical implications. Br J. Ophthalmol 2003; 87:1015-9.
7.Kwok AK., et al, Correlation of clinical and optical coherence tomography findings in postoperative macular hole closure. Ophthalmic Surg Lasers Imaging 2003; 34:25-32.
8.Parul S., et al, Optical Coherence Tomography, Ed. Jaypee Brothers, New Delhi, 2007.
INFORME REALIZADO POR:
Dr. José Luis Salinas Gallegos
Cirugía del Segmento Anterior, egresado de la Asociación para Evitar la Ceguera en México I. A. P.
Clínica de Retina de Guadalajara
Dr. Pablo Muñoz Rodríguez
Retina y vítreo, egresado de la Asociación para Evitar la Ceguera en México I. A. P.
Clínica de Retina de Guadalajara






No hay comentarios:
Publicar un comentario